Samenvatting
In deze tekst staat de betekenis van de darmflora voor de gezondheid van de gastheer centraal. Ook zal aandacht worden geschonken aan diverse vormen van floramodulatie. Bovendien zullen de voordelen van het gebruik van microbiologische Metabolieten boven het gebruik van levende micro-organismen (‘probiotica’) behan-deld worden. Uiteindelijk wordt geconcludeerd dat het gebruik van microbiële metabolieten voor een duidelijk omschreven groep van aandoeningen, met name diverse vormen van diarree, de voorkeur geniet boven het gebruik van klassieke probiotica.
Inleiding
Het gebruik van levende bacteriële preparaten is een gewoonte die zeer waarschijnlijk ouder is dan de welbekende weg naar Rome. Al sinds de oudheid kennen diverse volkeren de gewoonte om hun voedsel te vergisten met behulp van micro-organismen. Eén van de eerste meldingen van het gebruik van vergiste, of gefermenteerde voeding komt uit een onverwachte hoek: in het Oude Testament (Genesis 18:8) is reeds sprake van het gebruik van gefermenteerde melk. Sindsdien begint de gewoonte om tijdens voedselbereiding gebruik te maken van micro-orga-nismen aan een lange reis door de tijd.
 Met name de
productie van kaas, bier en wijn zijn hiervan goede
voorbeelden. De eerste poging om het effect van
gefermenteerde voeding op de gezondheid van de
gastheer wetenschappelijk te benaderen vindt plaats
aan het begin van de twintigste eeuw. In 1907
publiceert Eli Metchnikoff zijn Essais Optimistes
waarin het verouderingsproces van de mens
centraal staat. Eén van de hoofdstukken uit dat boek
gaat over het effect van voeding op de
levensverwachting. Uit de observatie dat Bulgaren aan het begin van de twintigste eeuw een relatief hoge levensverwachting hadden, concludeerde Metchnikoff dat hun voeding, en dan in het bijzonder hun yoghurt, mede voor die verhoogde levensverwachting verantwoordelijk zou kunnen zijn. Het orale gebruik van bacterie-preparaten voor het bestrijden van diverse darmaandoeningen wint aan populariteit in de periode tussen de wereldoorlogen. Onder invloed van de Tweede Wereldoorlog wordt de ontwikkeling van de moderne antibiotica, die in 1937 begint door de ontdekking van de sulfonamiden door Domagk, enorm versneld. Door deze ontwikkeling en door het overweldigende succes van deze preparaten vermindert de belangstelling van de reguliere medische gemeenschap voor de invloed van de darmflora op de gezondheid van de gastheer. In de alternatieve medische hoek, met name binnen de Duitse “Naturheilkunst”, blijft men echter geïnteresseerd in de darmflora en de modulatie daarvan. Sterker nog, het belang van een evenwichtige darmflora wordt binnen de natuurgeneeskunde vrij snel erkend. Deze ontwikkeling is goed te begrijpen. Binnen de natuurgeneeskunde baseert men zich immers op het aloude begrip van homeostase (=evenwicht). Verstoring van die homeostase door allerlei vormen van toxische belasting heeft een verminderd functioneren van het individu tot gevolg. Hoewel het homeostase-concept ook binnen de reguliere geneeskunde ingang vindt, krijgt het hier niet de fundamentele rol die het binnen de natuurgeneeskunde ten deel valt. Binnen de natuurgeneeskunde ontwikkelt het homeostase-concept zich inmiddels verder en evolueert tot een alternatieve ziekteleer: de humoraalpathologie.
Met name de
productie van kaas, bier en wijn zijn hiervan goede
voorbeelden. De eerste poging om het effect van
gefermenteerde voeding op de gezondheid van de
gastheer wetenschappelijk te benaderen vindt plaats
aan het begin van de twintigste eeuw. In 1907
publiceert Eli Metchnikoff zijn Essais Optimistes
waarin het verouderingsproces van de mens
centraal staat. Eén van de hoofdstukken uit dat boek
gaat over het effect van voeding op de
levensverwachting. Uit de observatie dat Bulgaren aan het begin van de twintigste eeuw een relatief hoge levensverwachting hadden, concludeerde Metchnikoff dat hun voeding, en dan in het bijzonder hun yoghurt, mede voor die verhoogde levensverwachting verantwoordelijk zou kunnen zijn. Het orale gebruik van bacterie-preparaten voor het bestrijden van diverse darmaandoeningen wint aan populariteit in de periode tussen de wereldoorlogen. Onder invloed van de Tweede Wereldoorlog wordt de ontwikkeling van de moderne antibiotica, die in 1937 begint door de ontdekking van de sulfonamiden door Domagk, enorm versneld. Door deze ontwikkeling en door het overweldigende succes van deze preparaten vermindert de belangstelling van de reguliere medische gemeenschap voor de invloed van de darmflora op de gezondheid van de gastheer. In de alternatieve medische hoek, met name binnen de Duitse “Naturheilkunst”, blijft men echter geïnteresseerd in de darmflora en de modulatie daarvan. Sterker nog, het belang van een evenwichtige darmflora wordt binnen de natuurgeneeskunde vrij snel erkend. Deze ontwikkeling is goed te begrijpen. Binnen de natuurgeneeskunde baseert men zich immers op het aloude begrip van homeostase (=evenwicht). Verstoring van die homeostase door allerlei vormen van toxische belasting heeft een verminderd functioneren van het individu tot gevolg. Hoewel het homeostase-concept ook binnen de reguliere geneeskunde ingang vindt, krijgt het hier niet de fundamentele rol die het binnen de natuurgeneeskunde ten deel valt. Binnen de natuurgeneeskunde ontwikkelt het homeostase-concept zich inmiddels verder en evolueert tot een alternatieve ziekteleer: de humoraalpathologie.
De darmflora
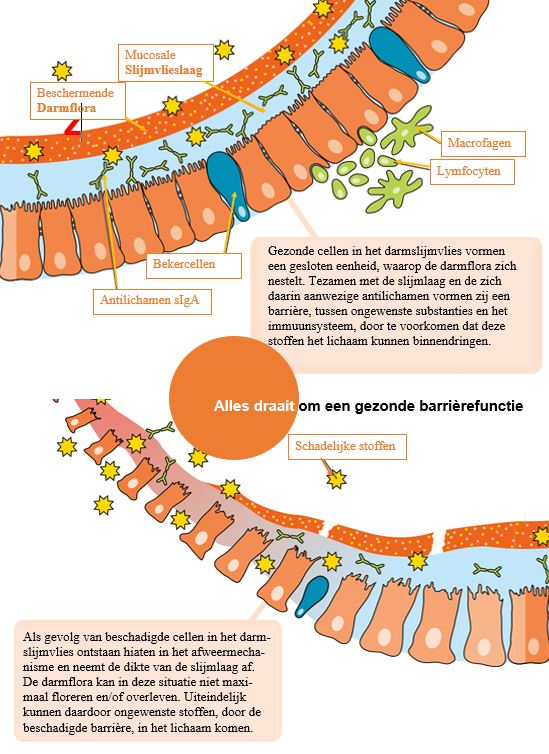
De samenstelling van de humane darmflora en de bijbehorende functies van de diverse bacteriële geslachten staat hieronder grafisch weergegeven in figuur 1.
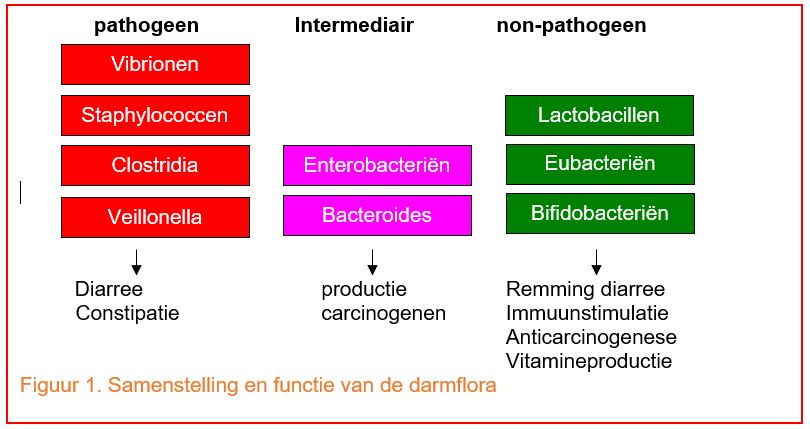
Het valt op dat m.n. aan de Lactobacillen, de Eubacteriën en de Bifidobacteriën ge-zondmakende of ‘probiotische’ effecten worden toegeschreven. Daarnaast wordt aan een groot deel van de bacteriën van de darmflora, potentieel pathogene of schadelijke effecten toebedacht. Hierbij moet wel direct een kanttekening geplaatst worden; de mate waarin een bacteriële symbiont een positief of negatief effect op de gastheer heeft, hangt slechts voor een deel samen met de eigenschappen van die symbiont zelf en deels met de conditie van het immuunsysteem van de gastheer. Sterker nog: bacteriën die altijd ziekteverwekkend (of: obligaat pathogeen) zijn, komen normaal niet in de darm voor. Men moet bij deze groep van bacteriën met name denken aan illustere soorten met welluidende namen als: Salmonella typhimurium, Yersinia pestis, Vibrio cholerae en Clostridium botulinum. Veruit de meeste darmbacteriën kunnen pas pathogeen worden als de gastheer dat toelaat. Zolang de gastheer gezond is zal deze hoofdzakelijk de positieve functies van de darmflora ondervinden. Hieronder worden een aantal belangrijke functies van de bacteriën, maar soms meer nog die van hun specifieke metabolieten, belicht. Het enorme belang van deze metabolieten en het hebben van een goed inzicht in ons microbioom worden hiermee snel duidelijk.
Het in stand houden van de kolonisatieresistentie
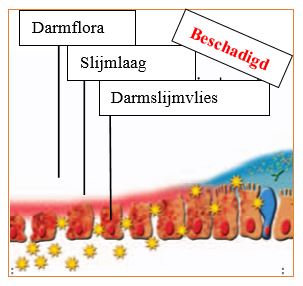
Ons microbioom bevat normaal gesproken veel verschillende bacteriestammen: heeft een hoge genetische diversiteit. Bij een afname van soortenrijkdom wordt het lichaam gevoeliger voor verschillende aandoeningen, zoals het prikkelbare darmsyndroom, voedselintoleranties en/of chronische darmziekten en infecties.
 Het gebruik van antibiotica is de belangrijkste en meest voorkomende oorzaak voor een afname
van de diversiteit. Als de soortenrijkheid ruim voldoende is komt de diversiteit overeen met de gebruikelijke verscheidenheid in soorten, die in de menselijke darmflora wordt
gevonden. De darmflora blijft daarmee stabiel en de kolonisatieresistentie (de mate waarin de darmbacteriën weerstand kunnen bieden tegen indringers van buitenaf) is hoog.
Dit houdt in dat het voor een binnenkomend micro-organisme (bijvoorbeeld de gist Candida albicans) nagenoeg onmogelijk is om “poot” aan de grond’ te krijgen in een stabiel
intestinaal ecosysteem waarin alle niches gevuld zijn
met de meest geschikte (non-pathogene) bacterie-
soort.
De “staat” van ons microbioom is derhalve een zeer
belangrijke parameter voor onze darmgezondheid
en daarmee onze totale gezondheid.
Wil je weten hoe het ervoor staat met jouw micro-
bioom of wil je meer informatie over de testmogelijk-
heden en/of de waarde van het testen van jouw
microbioom klik dan hier.
Het gebruik van antibiotica is de belangrijkste en meest voorkomende oorzaak voor een afname
van de diversiteit. Als de soortenrijkheid ruim voldoende is komt de diversiteit overeen met de gebruikelijke verscheidenheid in soorten, die in de menselijke darmflora wordt
gevonden. De darmflora blijft daarmee stabiel en de kolonisatieresistentie (de mate waarin de darmbacteriën weerstand kunnen bieden tegen indringers van buitenaf) is hoog.
Dit houdt in dat het voor een binnenkomend micro-organisme (bijvoorbeeld de gist Candida albicans) nagenoeg onmogelijk is om “poot” aan de grond’ te krijgen in een stabiel
intestinaal ecosysteem waarin alle niches gevuld zijn
met de meest geschikte (non-pathogene) bacterie-
soort.
De “staat” van ons microbioom is derhalve een zeer
belangrijke parameter voor onze darmgezondheid
en daarmee onze totale gezondheid.
Wil je weten hoe het ervoor staat met jouw micro-
bioom of wil je meer informatie over de testmogelijk-
heden en/of de waarde van het testen van jouw
microbioom klik dan hier.
Voedselvertering
Een aantal nutriënten is door de mens minder goed af te breken. Een bekend voor-beeld hiervan is lactose, dat door sommige, met name Afrikaanse en Aziatische, mensen niet afgebroken kan worden, omdat zij het enzym lactase niet tot expressie kunnen brengen. Het gevolg hiervan is dat de onverteerde lactose door de bacteriële flora in de dikke darm omgezet wordt in het zure lactaat. Dit lactaat prikkelt de darmmucosa die daarop meestal reageert met een sterk verhoogde productie van darmslijm of mucus. Het gevolg hiervan is diarree, kramp, pijn en gasvorming. Het zijn met name de melkzure bacteriën zoals Lactobacillus acidophilus en Bifido-bacterium bifidum die, middels de productie van specifieke metabolieten, in staat zijn de lactase-functie van de gastheer over te nemen zodat deze alsnog in staat is lacto-se op te nemen voordat deze in lactaat wordt omgezet. Er zal in dat geval geen diarree optreden.
Verlaging vrij cholesterol door het onderbreken van de Enterohepatische kringloop
Uit divers onderzoek is duidelijk geworden dat sommige micro-organismen (waarvan de best onderzochte een oude bekende is, namelijk Sacharomyces cerevisiae, oftewel bakkersgist, in staat zijn het geconjugeerde cholesterol samen met andere sterolen op te nemen. Door het onderbreken van de enterohepatische kringloop van de gastheer is het zo mogelijk de heropname van geconjugeerd cholesterol te remmen. Er zal hierdoor een verlaagde concentratie van vrij cholesterol in de circulatie ontstaan terwijl het overige cholesterol, ingebouwd in het betreffende micro-organisme, wordt afge-voerd via de dikke darm.
Productie van vitamines, zoals vitamine K en een aantal B-vitamines
Met name Bifidobacteriën produceren een aantal vitamines die voor de homeostase van de gastheer van belang zijn
Remming groei opportunistische kolonisten of potentieel pathogenen
Diverse Enterobacteriën en Enterococcen zijn tamelijk gevoelig voor de zuurgraad van het milieu. Een verlaging van de intestinale zuurgraad door bijvoorbeeld de melkzuur-producerende Lactobacillus- en Bifidobacterium-soorten in de darm blijkt in in-vitro experimenten en in dierstudies de groei van zowel Enterobacteriën als Enterococcen significant af te remmen. In het kader van de titel kan worden opgemerkt dat de intestinale zuurgraad wordt verlaagd door de aanwezigheid van de stofwisselings-producten (metabolieten) van de hierboven genoemde stammen.
Vergroten van de biologische beschikbaarheid van nutriënten
Deze functie blijkt met name gesteund te worden door een grote bibliografie van veterinair wetenschappelijke studies. Uit deze studies waar meestal twee of meer groepen van juveniele dieren van dezelfde soort (ruminanten, omnivoren of carnivoren) worden vergeleken blijkt dat de snelheid waarmee deze dieren groeien aanmerkelijk hoger ligt bij die groepen waar het dieet is aangevuld met m.n. Lactoba-cillus acidophilus en/of Sacharomyces cerevisiae. Dit type experiment is, vanwege overwegend ethische bezwaren, nog niet op mensen uitgevoerd, maar het ligt in de lijn der verwachting dat soortgelijke effecten ook voor de mens gelden.
Immuunstimulatie
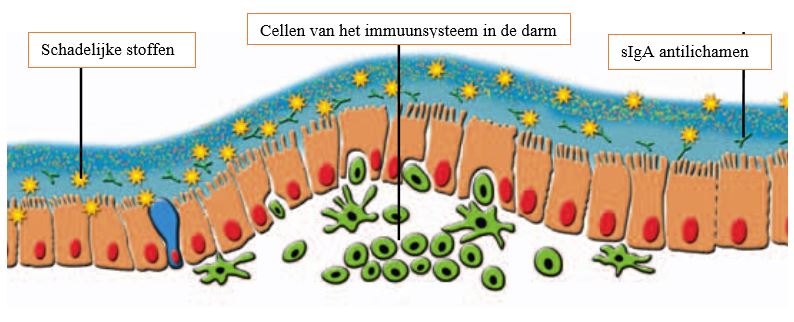
Dit is waarschijnlijk één van de belangrijkste, maar ook één van de minst begrepen aspecten van de darmflora. Het immuunsysteem van de mens heeft hoofdzakelijk contact met de antigenen in zijn milieu via de darm. De darm alleen al is een ‘antigene soep’ waarin een zeer grote hoeveelheid antigenen dagelijks passeert. Het zal dan ook geen verbazing wekken dat meer dan de helft van alle macrofagen en/lymfocyten (de belangrijkste vertegenwoordigers van respectievelijk het aspecifieke en het specifieke immuunsysteem) in en om de darmwand gelokaliseerd zijn. Uit diverse studies is inmiddels duidelijk geworden dat modulatie van de darmflora een verhoging van aspecifieke fagocytaire activiteit van de antigeen-presenterende cellen in en om de darm tot gevolg heeft.

Er wordt aangenomen dat deze verhoogde activiteit wordt waarschijnlijk veroorzaakt door de productie van diverse immuun stimulatoren, waarvan lipo-polysachariden uit de bacteriële celwand de bekendste zijn. Deze lipo-polysachariden (L.P.S.) zijn de metabolieten (stofwisselingsproducten) van een bepaalde Escherichia coli stam, die zich van nature in onze darmen bevindt (zie hiervoor ook tabel 1).

Door het meten van de stikstofmonoxide-productie door de macrofagen kan die verhoogde immuun activiteit worden vastgesteld. Daarnaast kan een antigeen in de darmflora een specifieke immuunrespons opwekken. Er is dan sprake van activatie van T-lymfocyten die vervolgens immunologisch geheugen (T-memory cellen) en een humorale immuunrespons door activatie van B-lymfocyten tot plasmacellen induceert. Deze plasmacellen produceren secretoir-IgA dat over de darmwand terug-getransporteerd wordt naar de darmholte. Merkwaardigerwijze blijkt deze laatste immuunreactie niet gebonden te zijn aan het darmslijmvlies. De geactiveerde lymfocyten kunnen zich verplaatsen via de bloedbaan, met als gevolg dat ze ook aan andere slijmvliezen, het eerdergenoemde secretoir-IgA, kunnen produceren. Weten-schappelijk onderzoek heeft aangetoond dat non-pathogene Escherichia coli en diverse Lactobacillus-soorten, dankzij de productie van stam specifieke metabolieten, in staat zijn een verhoging van de fagocytaire activiteit te induceren. Het gevolg hiervan is een betere bescherming tegen de micro-organismen die naar de bloedbaan van de gastheer dreigen over te gaan. Het mag uit deze opsomming duidelijk zijn dat de humane darmflora een zeer complex ecosysteem is (bestaande uit minstens 1.000 maal meer bacteriën dan er mensen op aarde leven) met een wijd functieareaal. Onderzoek naar de samenstelling en het functioneren van de darmflora vormt dan ook een essentiële diagnostische handeling voordat rationele therapie gestart kan worden.
Microbiële metabolieten
Het is inmiddels duidelijk dat een aantal bacteriën in staat zijn tot een wijd scala van gezondheid bevorderende effecten op de gastheer. De Lactobacillen, Bifidobacteriën, Escherichia coli en de gist Sacharomyces cerevisiae zijn daarvan de best onderzochte stammen. Ook zijn inmiddels een groot aantal van de metabolieten die voor die effec-ten verantwoordelijk zijn geïdentificeerd. In tabel 1 is een aantal van die metabolieten opgenomen. Goede voorbeelden van preparaten op basis van metabolieten zijn de producten die de Escherichia coli bevatten. In bovenstaande tabel 1 worden twee bekende metabolieten van de E.coli met de bijbehorende functies – lipo-polysachari-den die het immuunsysteem stimuleren en eiwitten ter bescherming van het darmslijm-vlies) binnen het gastro-intestinum benoemd.
Het gebruik van microbiële metabolieten geproduceerd door probiotische bacteriecul-tures is een relatief nieuwe therapie vorm. Het aantal preparaten op basis van (probi-otische) microbiële metabolieten valt dan ook in het niet vergeleken bij de hoeveel-heid ‘whole-cell’ probioticum preparaten. Dit is des te merkwaardiger als men de vele voordelen van het gebruik van microbiële metabolieten in ogenschouw neemt:
Het therapeutisch effect van preparaten op basis van metabolieten
Microbiële metabolieten kunnen geconcentreerd worden. Dit is een groot voordeel ten opzichte van het klassieke probioticum, dat voor zijn therapeutisch effect altijd afhan-kelijk is van de mate waarin deze in staat is uit te groeien in de darm van de gastheer. De hoge concentratie van de preparaten op basis van microbiële metabolieten garandeert veelal een veel groter therapeutisch effect.
Het gebruik van microbiële metabolieten zonder voorafgaande feces-diagnostiek is daarom (relatief) ook veiliger dan het blind inzetten van een levend probioticum. Reeds eerder werd opgemerkt dat de het ziekmakende effect van een micro-organisme deels wordt bepaald door eigenschappen van dat organisme zelf, maar ook door immunolo-gische eigenschappen van de gastheer.
Standaardisatie van preparaten op basis van metabolieten
Microbiële metabolieten zijn veel beter te standaardiseren, waardoor een constante samenstelling van het preparaat gegarandeerd kan worden. De hoeveelheid metabo-lieten welke in-vivo door een probioticum geproduceerd kunnen worden is van veel factoren afhankelijk en daarom vaak moeilijk voorspelbaar. De grotere en gestandaar-diseerde concentratie van de preparaten op basis van microbiële metabolieten geven de arts/therapeut de mogelijkheid de toegediende dosis exact te reguleren en daarmee het positieve effect van de therapie veel beter te kunnen voorspellen. Deze mogelijk-heid biedt het gebruik van een levend probioticum niet. Het is immers nooit met zekerheid te voorspellen hoe snel een levend probioticum na beëindiging van de therapie uit het darmkanaal zal verdwijnen.
Steriliteit en bewaarcondities van preparaten op basis van metabolieten
Microbiële metabolieten zijn in principe steriel. Eenmaal aangebroken hoeft dit type preparaat dan ook niet gekoeld bewaard te worden, zoals dat gebruikelijk is bij vloeibare probioticum preparaten. Dit maakt het gebruik van dit type preparaat onder niet-Westerse omstandigheden, zoals bijvoorbeeld in Derde Wereld, waar ten gevolge van slechte stroomvoorzieningen, nauwelijks betrouwbare koelkasten en vriezers voorhanden zijn, veel eenvoudiger. Ze zijn bovendien niet afhankelijk van de vitaliteit van de bacterie welke die metabolieten produceerde. Hierdoor kan dit type preparaat veel langer bewaard worden. Hoewel de probiotische preparaten die thans op de markt zijn alleen bestaan uit zogenaamde non-pathogenen, is het in het verleden reeds een aantal malen voorgekomen dat mensen met een zeer slecht afweersysteem, zeer oude mensen en pasgeborenen, geïnfecteerd raakten door bijvoorbeeld Lactobacillen. Omdat preparaten op basis van microbiële metabolieten altijd steriel zijn kunnen ze ook veilig aan mensen met een immuundeficiëntie worden voorgeschreven. Naast de hierboven opgesomde voordelen van het gebruik van microbiële metabolieten dient zeker aandacht besteed te worden aan de (on)mogelijkheden van dit type preparaat. Zo is het bijvoorbeeld uitgesloten dat preparaten op basis van microbiële metabolieten in staat zijn tot die functies die een volledig functionerende (probiotische) cel vereisen. Te denken valt dan aan: substraatcompetitie, competitie om adhesieplaatsen aan de enterocyten membraan en inclusie van geconjugeerd cholesterol in de cel.
Conclusie
Op basis van de bovenstaande verhandeling kan een aantal conclusies getrokken worden. De humane darmflora is van essentieel belang voor de integriteit en de overleving van het individu. Het heeft een groot aantal functies, die beïnvloedt kunnen worden door de samenstelling van die darmflora te moduleren. De samenstelling en het functioneren van de darmflora is enorm complex. Een zinvolle, verantwoorde en gerichte modulatie is daarom vrijwel uitsluitend mogelijk na voorafgaand laboratorium-onderzoek naar de samenstelling en het functioneren van die darmflora. Op basis van de informatie die de arts/therapeut ter beschikking heeft na onderzoek van de darmflora kan op rationele wijze een keuze voor de behandeling worden gemaakt. Naast het gebruik van microbiële metabolieten bij diverse dysbioses, verdient deze therapie in het bijzonder de voorkeur bij de behandeling van: infectieuze diarree, chronische non-infectieuze diarree en lactose-intolerantie. Ook zijn deze preparaten het middel van eerste keus bij ondersteuning en/of stimulatie van de eigen immuun functies en/of wanneer er geen laboratoriumonderzoek vooraf heeft plaats-gevonden. Het gebruik van microbiële metabolieten is essentieel als hierboven genoemde aandoeningen voorkomen bij patiënten met een sterk verminderde weerstand, ouderen en pasgeborenen. Het gebruik van probiotica bij deze patiënt-engroepen wordt daarom sterk afgeraden.
LITERATUUR REFERENTIES
1. Microb Cell Fact. 2021 Feb 5;20(1):36. doi: 10.1186/s12934-020-01477-z. Anti-cancer and anti-inflammatory effects elicited by short chain fatty acids produced by Escherichia coli isolated from healthy human gut microbiota Atchareeya Nakkar-ach 1 2, Hooi Ling Foo 3 4, Adelene Ai-Lian Song 5 6, Nur Elina Abdul Mutalib 7, Sunee Nitisinprasert 2, Ulaiwan Withayagiat 8 9 Affiliations + expand PMID: 33546705 PMCID: PMC7863513 DOI: 10.1186/s12934-020-01477-z
2. https://www.darmgezondheid.nl › nieuws-fmt-colitis-ul... Remissie bij colitis ulcerosa na poeptransplantatie 11 apr. 2019 — Bepaalde bacteriën en metabolieten lijken verantwoordelijk voor ... met als doel het evenwicht van bacteriën te herstellen in de darm. Oncology, Tumor Biology Centre at the Albert-Ludwigs-Universitya, Freiburg i. Br. (Germany), Laves Arzneimittel GmbHb, Ronnenberg (Germany), Insitute of Biometry, Medical Schoolc, Hannover (Germany), Department Oncology, Klinik Bad Trissld, Oberaudorf (Germany), Department Surgery, DRK Kranken haus Mark Brandenburg6, Berlin (Germany), University of Hamburg, Toxicology and Environmental Medicine ATUf, Hamburg (Germany)
3. https://www.radboudumc.nl › nieuws › bacteriegenen-u... Simulaties kunnen moeilijk experimenteel onderzoek vervangen 16 mrt. 2018 — Bacteriegenen uitstekende voor-speller voor aanwezige metabolieten ... voor veranderingen in de metabolieten-samenstelling in de darm, ...
4. https://www.ncbi.nlm.nih.gov › pmc Function and biogenesis of lipopolysaccharides - NCBI door B Bertani · 2018 · Geciteerd door 95 — One of the most studied bacterial surface molecules is the glycolipid known as lipopolysaccharide (LPS), which is produced by most ...
5. Microbiologische metabolieten in ziekte en gezondheid (2010). Dr. G.J. Jansen. wetenschappelijk onderzoeker werkzaam op de disciplinegroep Medische Microbiolo-gie van de universiteit van Groningen. In 1994 promoveerde hij op een onderzoeks-project waarin de effecten van orale therapie met Enterococcus faecalis en Escherichia coli op de werking van het humane immuunsysteem werden beschreven.
6. Arzneim.-Forsch./Drug Res. 51 (I), 332-338 (2001) © ECV ■ Editio Cantor Verlag, Aulendorf (Germany). Double-blind Randomised Placebocontrolled Phase III Study of an E. Coli Extract plus 5-Fluorouracil versus 5-Fluorouracil in Patients with Advanced Colorectal Cancer. Clemens Unger3-1], Brigitte Häring8, Anne Kruseb, Anne Thu-mannb, Berthold Schneider0, Christoph Clemmd, Bernhard Weberd, Hans-Dietmar Cleverte, Stefan Hockertzf, and Markus B. Kalousekb Department Medical